“去年,关于120万一针的CAR-T天价疗法的新闻传遍大江南北。而付出如此昂贵的代价,白血病又是否得以真正治愈呢?近日,新浪、腾讯、搜狐等多家媒体纷纷报道,美国CAR-T之父Carl June教授在著名期刊《Nature》发表论文,详细介绍了世界第一位接受 CAR-T治疗的患者 Bill Ludwig和第二位接受CAR-T治疗的 Doug Olson的治疗结果。在接受治疗超过十年之后,两人体内均一直未再检测到白血病迹象, Carl June教授表示,现在可以认为CAR-T确实可以真正治愈白血病。
图a. 媒体新闻报道[1]
在这项研究中,Carl June实验室应用了Fluidigm CyTOF质谱流式技术,对CAR-T细胞的表型和功能进行了深入且长期的追踪研究,以下,我们就为您就这项研究成果做详细介绍。”
[1] 新闻引自:
《搜狐网》https://www.sohu.com/a/520537897_121124565
《腾讯网》https://new.qq.com/rain/a/20220203A0245700
《新浪财经》https://cj.sina.com.cn/articles/view/5044281310/12ca99fde02001r4be

CAR-T疗法,即嵌合抗原受体T细胞免疫疗法,是将患者的T淋巴细胞(具有天然抗感染和抗癌作用)分离出来,通过基因重新编辑让T淋巴细胞带上能够识别肿瘤细胞抗原的受体,并进行大规模的体外扩增CAR-T细胞,再回输到患者体内,CAR-T细胞便会特异性地攻击肿瘤细胞,从而快速、精准地治疗肿瘤。CAR-T疗法在多种癌症中显示了治疗潜力。然而,对输入体内的CAR-T细胞的长期潜力和克隆稳定性知之甚少。
2022 年2月2日,宾夕法尼亚大学&费城儿童医院的研究人员在 Nature杂志在线发表了题为Decade-long leukaemia remissions with persistence of CD4+ CAR T cells的文章【1】,并受到了广泛的关注。作者利用Fluidigm质谱流式技术(CyTOF)和CITE-seq等多组学技术深入分析了CAR-T治疗不同阶段患者体内的CAR-T细胞特性和变化,首次揭示了长期持久CAR-T细胞的特征。
作者利用质谱流式,设计了由40个markers组成的panel,其中35个marker(表面和胞内)用于识别T细胞, 另外5个marker用于去除非T细胞。对两位十年前首批接受CAR-T治疗后获得完全缓解的慢性淋巴细胞白血病患者进行跟踪检测。
患者1中,CAR-T输入后1.8个月,CD8+CAR-T细胞占比29.3%,在随后的时间点出现比例下降;CAR-T细胞输入后1.4年,CD4+ CAR-T细胞占比97.5%;CAR-T细胞输入后3.4年到9.3年;CD4+ CAR-T细胞占比99.6%(图1a-c)。患者2中,以更加延迟的CAR T细胞扩增为特征,并表现整体相似的趋势。CD8+CAR-T在初始时间点为主要的亚群,随后逐渐减少,CAR-T细胞输入后7.2年,CD4+CAR-T细胞占比97.6%。同时发现CD4-CD8-CAR-T细胞亚群在患者2中很明显,CAR-T细胞输入后2.5个月和1.6年,分别占总CAR-T细胞的33.4%和46.5%;CAR-T细胞输入后2.8年、4.7年和7.2年,分别减少到12.9%、8.2%和0.5%(图1b, c)。该细胞亚群有着独特的细胞表型,表达细胞毒性标记物GZMB, 2B4,CD57, CD85j,T-bet和PD-1,以及Helios(Helios--T细胞活化和增殖的一种标志物-编者注【2】)。这些特征明显地将该亚群与其他类似的细胞毒性CD8+ T细胞区分开(图1b)。基于这种独特的标记,作者将其标记为CD4-CD8- Helioshi CAR-T细胞。该亚群在患者1输入CAR-T细胞1.8月的样本中比率较低(3.2%),并在CAR-T细胞输入后1.4年变得更少(小于1%)(图1c)。
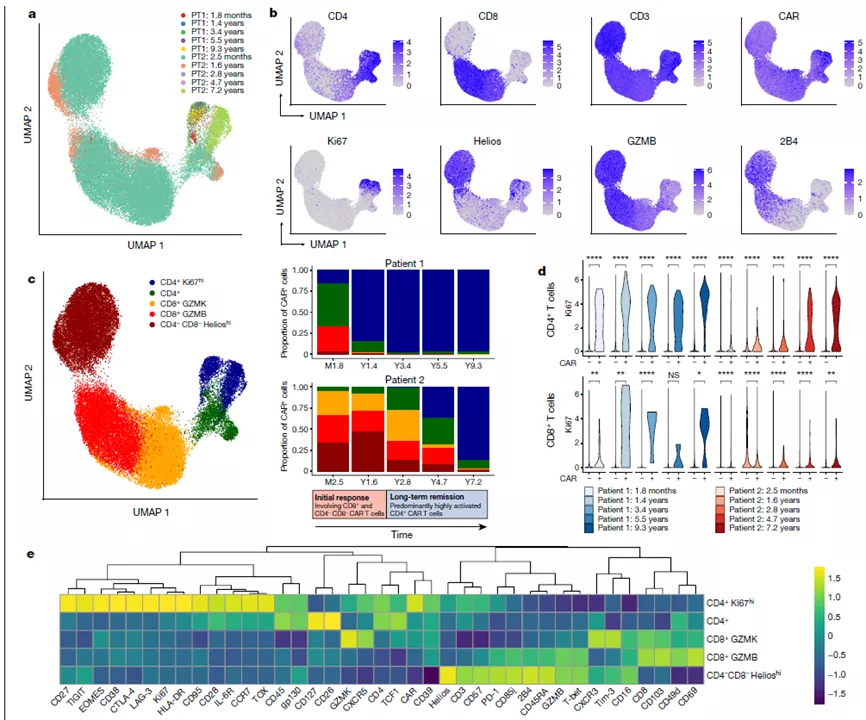
图1.质谱流式多个时间点分析CD3+ CAR-T细胞。a. UMP降维分析患者不同时间点的CD3+ CAR-T细胞,颜色代表采样时间点;b. 选定细胞标记物的蛋白表达; c. UMAP降维展示5个主要的CAR - T细胞群组成,颜色代表细胞亚群;d. 统计分析不同细胞中Ki67的表达;e. CAR - T细胞亚群中各标记物表达的热图。
CD4+ CAR-T细胞高表达Ki67,为增殖表型(图1b)。在两例患者中,Ki67hiCD4+ CAR-T细胞稳步出现。患者1中,CAR-T细胞输入后1.8个月时占总CAR-T细胞的15.9%;CAR-T输入后9.3年增加到97.0%。患者2中,Ki67hi CD4+ CAR-T细胞在CAR-T细胞输入后2.4个月时占0.2%, CAR-T细胞输入后7.2年增加到87.2%(图1b, c)。比较CAR+ CD4 T细胞和CAR- CD4 T细胞,发现Ki67的表达具有很强的CAR+ T细胞特异性(图1d)。CD8+ CAR-T细胞整体上也表现出增殖趋势,但是Ki67的表达普遍较CD4+ CAR-T细胞低且不稳定(图1d)。且Ki67hi CD4+T细胞表达了不同的标志物,包括激活标志物CD38、HLA-DR和CD95、转录因子EOMES和TOX、检查点标志物CTLA-4, LAG-3和TIGIT,以及记忆型标志物CD27和CCR7(图1e)。
综上结果表明两名患者体内的CAR-T细胞治疗经历了两个不同的阶段,初始阶段以CD8+CAR-T和CD4-CD8- CAR-T细胞为主,负责杀伤肿瘤细胞,而长期缓解阶段则以CD4+CAR-T细胞为主,负责控制肿瘤细胞,且CD4+CAR-T细胞表现出持续增殖和杀伤肿瘤细胞的特性,是持久临床反应的关键特征。想要长久控制肿瘤,也需要多种不同CAR-T细胞类型的组合。此项研究为与抗癌反应和长期缓解相关的CAR-T细胞特征提供了新的见解,且为CAR-T细胞疗法的长期治疗效果和整合到体内的安全性提供了概念证明。Carl June表示,现在可以认为CAR-T确实可以真正治愈白血病。
这项研究成功地运用了CyTOF技术,对患者体内CAR-T细胞表型和功能进行深入而细致的分析。Fluidigm质谱流式技术是一种高通量单细胞蛋白质分析技术,利用金属元素作为抗体的标签,以质谱作为检测手段,可同时分析单细胞表面和内部的50多种标志物,由于采用特殊的金属元素作为检测信号,背景信号极低,彻底解决传统流式的荧光串色的问题,并在多领域得到广泛应用。
1. Melenhorst J. J.,Chen G. M., Wang M. et al. "Decade-long leukaemia remissions with persistence of CD4+ CAR T cells." Nature. 2022 Feb 2. doi: 10.1038/s41586-021-04390-6.2. Tatiana Akimova, Ulf H Beier, Liqing Wang, et al. "Helios expression is a marker of T cell activation and proliferation" PLoS One2011;6(8):e24226. doi: 10.1371/journal.pone.0024226. Epub2011 Aug 30.








