
再灌注治疗是应对急性心肌梗死的重要方式,可有效帮助缺血组织恢复供血供氧。然而缺血组织恢复血流后可能发生再灌注损伤,导致心肌损伤程度进一步加剧。目前,再灌注损伤的发生机制仍不完全清楚。先前已有研究使用单细胞测序技术对再灌注损伤所涉及的细胞类型复杂的异质性进行探究,但该技术不能保存细胞在组织内的空间信息;另一方面,常规转录组分析无法在单细胞层面上研究蛋白质翻译后修饰。除此之外,如何防止再灌注损伤的发生也是研究中的重要课题。
为了解决这些难题,中国医学科学院阜外医院心血管疾病国家重点实验室的王利教授团队利用Standard BioTools公司的组织成像质谱流式(Imaging mass cytometry, IMC)技术对小鼠再灌注损伤模型的心脏单细胞蛋白修饰时空图谱进行了描绘。该研究名为“Spatial Multiplexed Protein Profiling of Cardiac Ischemia-Reperfusion Injury”,已于2023年5月30日发表于《Circulation Research》(IF = 23.213)。
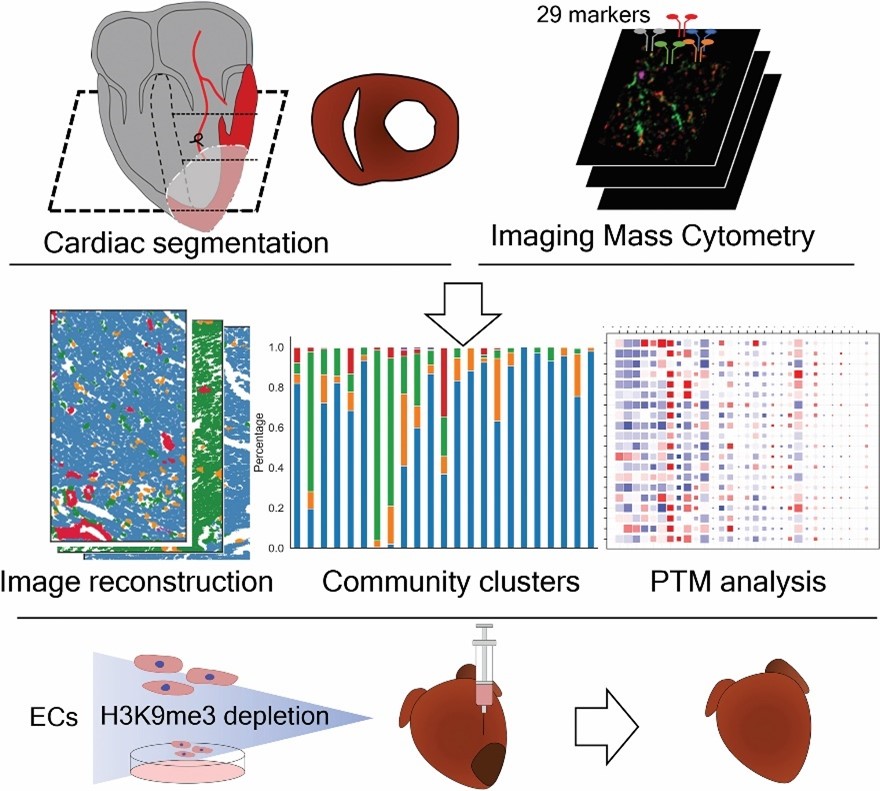
图1. 研究示意图
组织成像质谱流式技术利用金属标签抗体代替传统的荧光抗体对切片进行染色,以飞行时间质谱的检测方式区分不同的金属同位素标签,可在单张切片上同时检测数十种靶标。该技术无需循环染色并彻底解决荧光基团间严重的串色问题,兼具通道多、背景低、数据质量高等特点。通过分析,研究者可在单细胞层面获得数十种蛋白表达水平及细胞定位,从而深入挖掘细胞表型和功能及分析细胞间位置关系。这项研究使用的panel包含29个抗体,其靶标除了细胞分型标志物外,还涵盖了与再灌注损伤相关的激酶通路和甲基化、乙酰化等组蛋白修饰的靶标。
研究使用了小鼠心肌缺血再灌注损伤模型,在缺血前和再灌注后共8个时间点采集样品,将小鼠心脏分为基底部(basal)、中部(mid-cavity)、心尖部(apical)和心尖(apex),将每个部分的前壁(anterior)、侧壁(lateral)和下壁(inferior)分别进行研究,共12个部分。在对所有时间点和所有分区的组织切片进行染色和采集数据后,研究团队共获得了251组图片,通过分析得到了197063个单细胞数据。
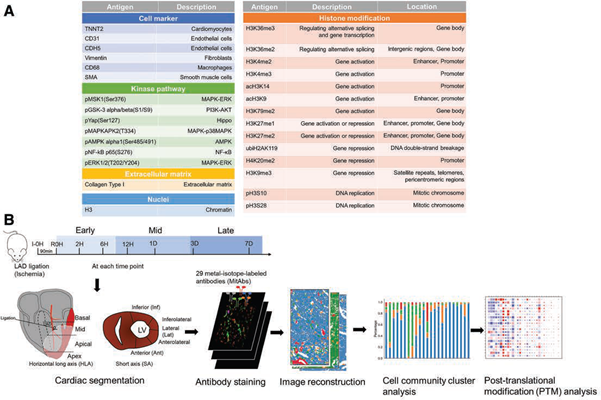
图2. 研究panel (A) 及流程(B)
通过分型标志物,心脏细胞可被定义为心肌细胞(CM)、内皮细胞(EC)、成纤维细胞(FB)、巨噬细胞(MP)和平滑肌细胞(SMC)等类型。在再灌注损伤三天后,部分区域出现心肌细胞显著损失;同时,相同区域内纤维化程度明显增加。血管生成则分为两个阶段:数小时内的快速生成多发生在基底部和中部,而至少12小时后的中长期响应则发生在心尖部。这些现象说明该模型与已知病理反应相符,也证明了IMC捕捉动物模型心室壁细胞变化的能力。
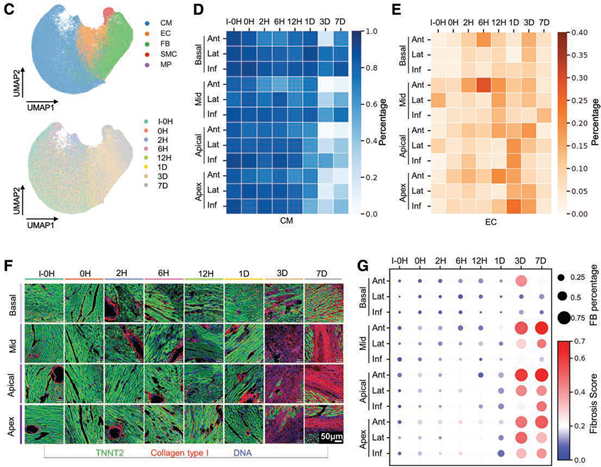
图3. 不同细胞类型的时空变化;(C) 根据表达量区分单细胞的UMAP图;(D)热图显示心肌细胞细胞在各时间点各区域的量;(E)热图显示内皮细胞在各时间点各区域的量;(F)IMC图片显示不同时间点的心肌细胞和纤维化标志物;(G) 各时间点各区域纤维化打分
接下来,研究团队进行了细胞社群分析,利用细胞间空间位置数据将细胞分成23类不同的群落(community clusters, CCs)。其中大多数群落中的主要细胞类型为心肌细胞,有三类群落中最多的是成纤维细胞,另有三类相对富集内皮细胞和三类相对富集平滑肌细胞的群落。分析发现细胞群落与局部组织结构有明显关联,集中体现在不同群落距离不同类型血管的远近上。研究团队进一步比较了健康心脏与再灌注损伤后细胞群落的变化,发现损伤后细胞群落快速改变,而梗死区域、边缘区域和遥远区域的变化趋势并不相同。这不仅揭示了再灌注损伤后病理反应的异质性,也再次说明了研究不同解剖位置的重要性。
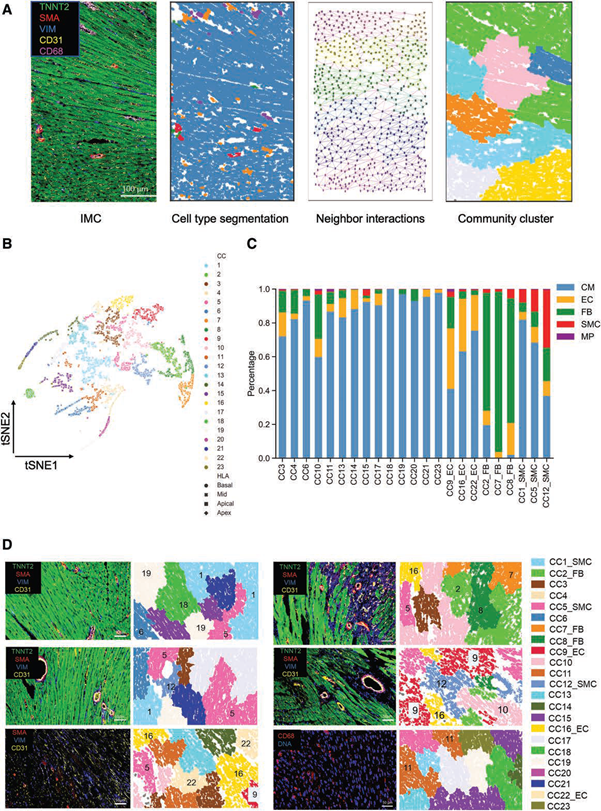
图4. 细胞群落鉴定;(A)群落分析示意图;(B)23类群落的tSNE图;(C)不同群落的细胞组成;(D)代表性的IMC及对应群落图像
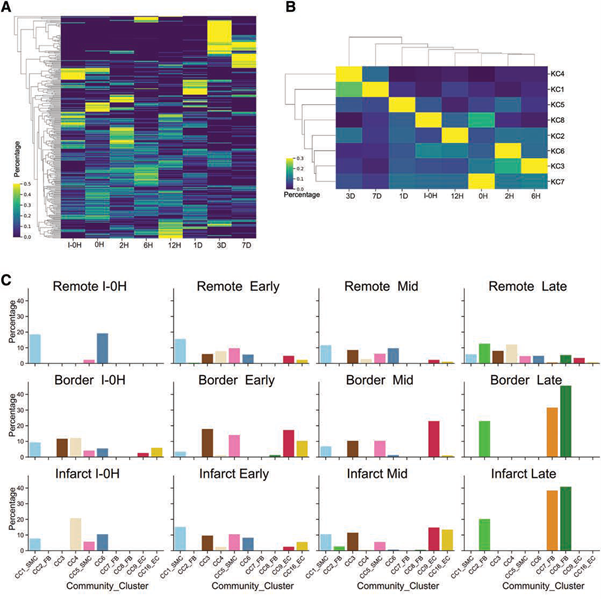
图5. 再灌注损伤后细胞群落快速变化;(A)不同区域各群落随时间的变化;(B)聚类分析显示每个时间点对应一种群落模式,说明群落随时间快速变化;(C)再灌注损伤后梗死、边缘和遥远区域显著改变的群落
为了揭示再灌注损伤后关键的信号转导与表观遗传学变化,研究人员利用IMC的多靶标panel分析了7种磷酸化蛋白和14种组蛋白翻译后修饰事件。信号通路激活也表现出区域特异性,以梗死的边缘区域最为明显。时间轴上,RAS-ERK通路被迅速激活,而其他通路在至少一天后才有明显激活,说明它们在损伤修复等过程中可能有作用。与此相对的是,信号通路激活的区域通常对应着较少的组蛋白修饰。
研究者接下来使用无监督聚类分析产生了13类翻译后修饰簇(posttranslational modification intensity (PTMI) subgroups),用以进一步确立与时空关联的细胞特异性翻译后修饰特征。其中,再灌注损伤中期的翻译后修饰簇中富集内皮细胞的细胞群落含量明显增加,说明内皮细胞的信号通路与表观遗传学改变对再灌注损伤进展至关重要。而晚期变化则与成纤维细胞主导的细胞群落相关。
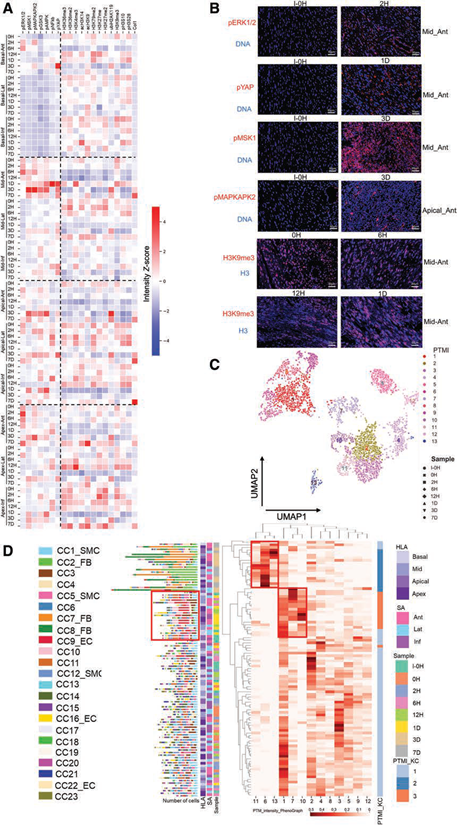
图6. 信号通路与表观遗传调节;(A)各区域各时间点的翻译后修饰信号强度;(B)IMC图片显示翻译后修饰信号改变;(C) 13类翻译后修饰簇的UMAP显示;(D)聚类分析将翻译后修饰信号分为三大类(PTMI_KC),分别对应不同时间区段
通过深入分析再灌注损伤中期的翻译后修饰变化,研究人员发现梗死和边缘区域的内皮细胞中H3K9me3明显升高。为了验证H3K9me3的作用,他们使用了经体外编辑后降低了H3K9甲基化的内皮细胞。注射有这种内皮细胞的小鼠心脏在再灌注损伤后射血分数和缩短分数明显改善,血管生成增多,而纤维化明显降低。其他实验进一步证明了H3K9me3直接调节内皮细胞功能基因的表达。因此,H3K9me3有望成为再灌注损伤干预的新靶点。
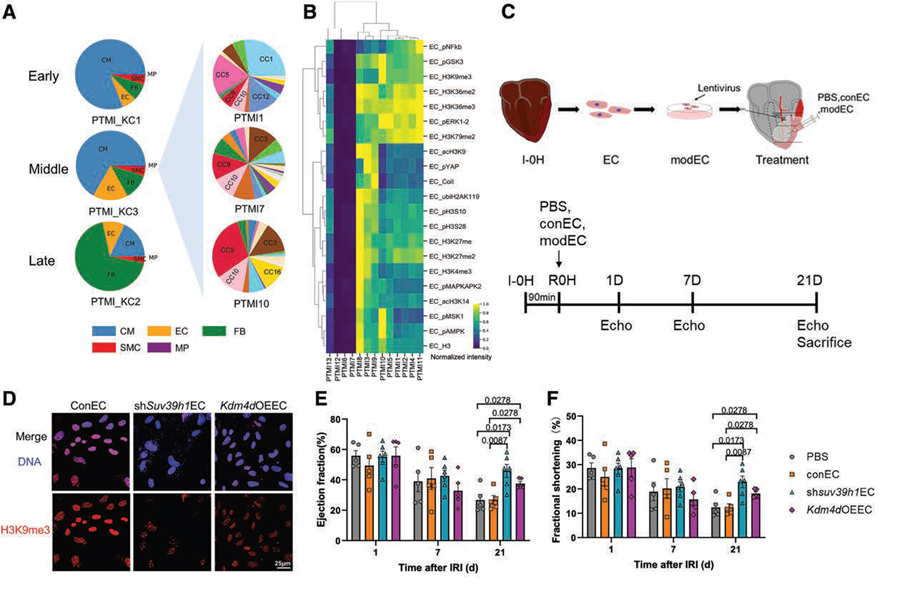
图7. 降低内皮细胞H3K9me3改善再灌注损伤结果;(A)三大类翻译后修饰信号群中细胞类型(左)和PTMI_KC3中细胞群落组成(右);(B)内皮细胞各PTMI中翻译后修饰信号强度;(C)注射编辑后内皮细胞的实验流程;(D)体外编辑降低H3K9me3强度;(E)降低内皮细胞H3K9me3后射血分数和缩短分数明显改善
这篇文章是IMC在心血管疾病领域的极佳应用案例。研究团队利用IMC通道多、背景低等特点,对心肌梗死再灌注损伤后各解剖区域和时间点进行了全面的单细胞分析,并克服了单细胞测序等手段的不足,探究了疾病相关的细胞群落、信号通路和表观遗传学变化,并最终发现了细胞特异的新潜在治疗靶点。在此,我们对中国医学科学院阜外医院的研究团队表示衷心的祝贺!
参考文献:
Spatial Multiplexed Protein Profiling of Cardiac Ischemia-Reperfusion Injury. Circ Res. 2023 Jun 23;133(1):86-103. doi: 10.1161/CIRCRESAHA.123.322620.













