胰腺导管腺癌(PDAC)是致死率最高的实体瘤之一。超过 80% 的 PDAC 患者在接受手术切除后仍会出现疾病复发。免疫检查点阻断剂改变了包括黑色素瘤和肺癌在内的实体瘤晚期患者的前景,但只有一小部分 PDAC 患者可能从中受益。PDAC 在免疫学上表现出 "冷"肿瘤微环境(TME),其特点是促进肿瘤的免疫细胞(如髓源抑制细胞(MDSCs))的浸润,而且通常缺乏 CD8+T 细胞,导致细胞毒性效应功能丧失。近日,复旦大学附属肿瘤医院虞先濬/施思教授团队在Gut上发表了名为《CRIP1 fosters MDSC trafficking and resets tumour microenvironment via facilitating NF-κB/p65 nuclear translocation in pancreatic ductal adenocarcinoma》的文章,利用质谱流式(CyTOF®),组织成像质谱流式(IMC™)等多种不同的技术,研究了PDAC肿瘤细胞在肿瘤免疫微环境(TIME)形成中的机制,并根据基因型异质性为PDAC患者提供潜在的联合治疗策略。
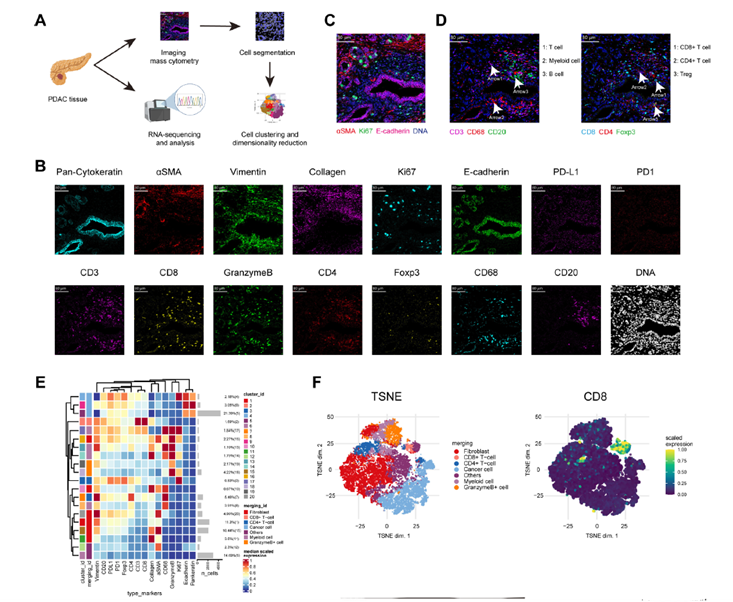
为了探索 PDAC 的微环境及其形成机制,研究者利用 Standard BioTools商品化的17 个marker的肿瘤免疫panel,对 40 例 PDAC 患者的肿瘤标本进行了多参数 IMC™ 分析(图 1A),检测了肿瘤中的主要的细胞类型,包括 E-cadherin+上皮细胞和 αSMA+成纤维细胞,以及增殖标志物 Ki-67,并检测到三个免疫细胞亚群:CD3+T细胞、CD68+髓系细胞和CD20+B细胞。在 T 细胞中进一步识别出 CD8+T 细胞、CD4+T 细胞和 Tregs。由于IMC™具有亚细胞级别的分辨率,能够在空间水平对单细胞进行分析,因此研究者进一步对扫描图像进行单细胞划界,并使用 FlowSOM 鉴定出 20 个细胞元群,根据细胞类型特异性标志物的不同表达水平,这 20 个细胞元群被手动合并为7 个细胞群,包括 3 个癌细胞群、6 个成纤维细胞群和 8 个免疫细胞群。邻域分析表明,这些细胞群之间存在大量的相互作用或回避关系,这进一步表明了 PDAC 微环境中存在着复杂的细胞交流。由此可以看出,利用IMC™技术不仅可以对肿瘤免疫微环境中复杂的细胞亚群进行分析,还能够在空间水平解析细胞与细胞之间的相互作用关系。由于 CD8+T 细胞反映了免疫微环境的激活情况,作者根据 CD8+T 细胞的浸润情况将样本分为两组然后对这两组样本的肿瘤标本进行 RNA 测序分析,对比TCGA的正常组织,发现了差异化的两个基因, 并选择了CRIP1 作为进一步研究的对象。
图1.CRIP1 是一种与与 PDAC 的低免疫激活有关的关键促癌蛋白。(A)获取和分析 40 例 PDAC 标本数据的示意图。(B) 使用所述标志物的抗体进行染色的代表性图像。(C)E-cadherin 用于区分上皮细胞,αSMA 用于区分成纤维细胞,Ki-67 用于区分增殖细胞。(D) CD3、CD4 和 CD8 用于表示 T 细胞,CD68 用于表示髓系细胞,CD20 用于表示 B 细胞。(E)通过手动合并 FlowSOM 生成的 20 个元群得到的 7 个细胞群中 15 个标志物强度中位数的热图。(F)t-SNE 图中人工合并得到的 7 个细胞群;t-SNE 图中 PDAC 样本细胞中 CD8 的表达。
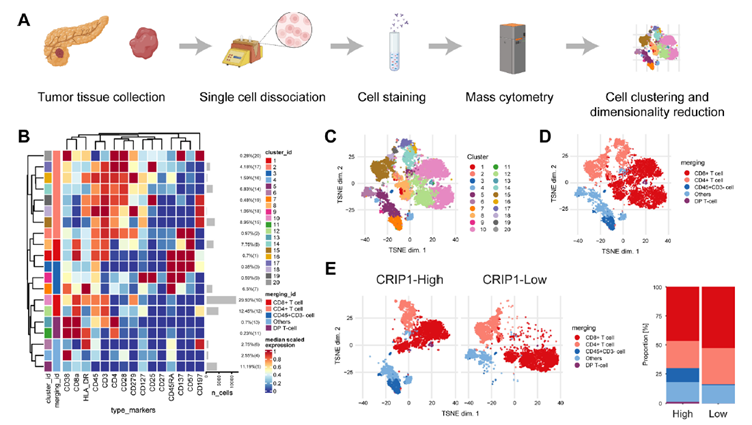
由于组织成像质谱流式系统具有一机双模的特点,不仅能够检测切片样本,还能够对肿瘤样本的单细胞悬液进行质谱流式(CyTOF®)分析。为了进一步探索 CRIP1 在免疫抑制中的作用,研究者为T细胞和非T细胞分别设计了15 个和 17 个marker的panel,利用CyTOF®技术检测了20 例患者的新鲜 PDAC 样本。作者首先对 T 细胞中的标志物表达水平进行了分析,使用 FlowSOM 鉴定出 20 个细胞元群,最终合并得到了 5 个细胞群。之后作者用t-SNE对这些细胞元群、细胞群和代表性标志物的分布进行了可视化(图2 B-E)。结果显示,CRIP1 高表达组别的 CD8+T 细胞和 CD4+T 细胞浸润减少,衰竭标志物 CD279 的表达增加。CD279 表达的增加同时出现在 CD4+T 细胞和 CD8+T 细胞中,这表明 PDAC 中存在广泛的 T 细胞衰竭。在 CRIP1 高表达的样本中,一些 CD4+T 细胞的 CD25 表达较高,可能是 Tregs。同时,CD45+CD3-细胞群在 CRIP1 高表达的肿瘤中明显富集,这表明不同类型的肿瘤在非 T 细胞富集方面存在很大差异。
接下来作者通过 t-SNE 和FlowSOM分析非 T 细胞,鉴定出了 20 个细胞群,并将总细胞群分为 8 个亚群,发现 MDSCs 在 CRIP1 高分组中明显富集。另外,作者发现, CRIP1 的表达与 PDAC 中 CD8+T 细胞的浸润呈强负相关,与PDAC中MDSC 的浸润呈强正相关,而在其他肿瘤中则不然。基于这些结果,CRIP1 在 PDAC 中诱导高 MDSC 浸润和低 T 细胞浸润,在 PDAC 免疫微环境中的作用可能比在其他肿瘤中更重要。CRIP1 表达的升高诱导了高水平的髓源性抑制细胞(MDSC)浸润,并促进了免疫抑制性肿瘤微环境的形成。结合其他的技术手段,研究者进一步探究了具体的机制,发现CRIP1/NF-κB/CXCL 轴对于引发 PDAC 的免疫逃避和 TIME 的形成至关重要。阻断这一信号通路可阻止 MDSC 的迁移,从而使 PDAC 对免疫疗法敏感。
图2. CRIP1 在 PDAC 微环境中诱导高 MDSC 浸润和低 T 细胞浸润。(A)CyTOF® 数据采集示意图,包括组织制备、抗体染色、上机、数据的聚类和降维。(B) T细胞panel中, FlowSOM 生成的 20 个元群合并得到的 5 个细胞群中15 个标志物的表达热图。(C)T细胞panel中,FlowSOM 得到的20个元群的t-SNE结果图。(D)T细胞panel中,通过人工合并得到的五个细胞群的 t-SNE 结果图。(E)T 细胞浸润在 CRIP1 高/低组中的 t-SNE 图。
在这篇文章中,作者利用组织成像质谱流式系统分析了PDAC肿瘤组织的原位信息和空间分布,为肿瘤组织中微环境提供了全面的视角,并且结合CyTOF®分析技术对细胞的组成和功能进行了进一步的挖掘,从多角度分析了肿瘤的微环境,提高了实验的深度。另外值得一提的是,在本研究工作中,实验的顺利开展以及研究成果的快速发表,也正是基于质谱流式实验设计简单,实验结果可靠,具有完整的解决方案等特点。同时,更离不开研究者们辛勤的工作,因此也再次对复旦大学附属肿瘤医院虞先濬/施思教授团队表示衷心的祝贺。
参考文献:
Liu X, Tang R, Xu J, et al. CRIP1 fosters MDSC trafficking and resets tumour microenvironment via facilitating NF-κB/p65 nuclear translocation in pancreatic ductal adenocarcinoma[J]. Gut, 2023.